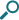製品特性
COPDに対する効果

24時間の呼吸機能改善効果
レルベアは、アドエアとの比較試験において、1日1吸入で、24時間の呼吸機能改善効果を示しました
投与後0~24時間FEV1加重平均値のベースラインのトラフ値からの変化量(投与84日目)(ITT)[第III相試験:海外データ(主要評価項目)]
承認時評価資料
Dransfield MT et al:Respir Med 2014;108(8), 1171-1179
同じ目的・デザインで行われた別の臨床試験(HZC112352試験)では、投与84日目における投与後0~24時間のFEV1加重平均値のベースラインのトラフ値からの変化量の最小二乗平均値はアドエア250群0.114Lに対し、レルベア100群0.142Lであり、その投与群間の差は統計学的に有意ではなかった(p=0.267:ベースラインのFEV1値、可逆性、試験開始時の喫煙状況、国および治療を共変量としたANCOVA)。
HZC113109試験
目的
COPD患者を対象に、レルベア100を1日1回またはアドエア250を1日2回、12週間吸入投与し、24時間の呼吸機能を比較検討する。
対象
10pack-years※以上の喫煙歴があり、サルブタモール吸入後の1秒量(FEV1)/努力性肺活量(FVC)比が0.70以下、かつFEV1が予測値の70%以下である、40歳以上のCOPD患者519例
※1日1箱(20本)を10年間続けた状態
方法
多施設共同・層別割付・無作為化・二重盲検・ダブルダミー・並行群間比較試験。患者をレルベア100群またはアドエア250群に無作為に割付けた。いずれも投与期間は12週間とした。
評価項目
有効性評価項目…
主要評価項目 : 投与84日目における投与後0~24時間のFEV1加重平均値のベースラインのトラフ値からの変化量
副次評価項目 : 投与1日目における効果発現(FEV1値がベースラインから100mL以上増加)までの時間
その他の評価項目: 救済薬サルブタモール未使用期間等
安全性評価項目…
有害事象・肺炎の発現頻度等
解析計画
本試験は優越性試験であり、レルベア100とアドエア250の有効性が比較された。投与84日目における投与後0〜24時間のFEV1加重平均値のベースラインのトラフ値からの変化量は、ITT集団を対象にANCOVAモデルを用いて解析した。
承認時評価資料
Dransfield MT et al:Respir Med 2014;108(8), 1171-1179
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者には、グラクソ・スミスクライン(株)の社員が含まれた。
本試験における安全性 [安全性評価項目]
副作用の発現頻度は、レルベア100群3%(7/260例)、アドエア250群4%(11/259例)であった。いずれかの群で2例以上に発現した主な副作用は、口腔カンジダ症[レルベア100群1例(<1%)、アドエア250群3例(1%)]、鼻咽頭炎[レルベア100群0例、アドエア250群2例(<1%)、中咽頭カンジダ症[レルベア100群0例、アドエア250群2例(<1%)]であった。試験中止または試験薬剤の投与中止に至った有害事象は、レルベア100群4例(2%)、アドエア250群8例(3%)で報告された。アドエア250群1例は重篤な心肺停止により死亡に至ったが、試験薬剤との関連なしと判断された。
承認時評価資料
同じ目的・デザインで行われた別の臨床試験(HZC112352試験)において、副作用の発現頻度は、レルベア100群4%(11/259例)、アドエア250群7%(18/252例)であった。いずれかの群で3例以上に発現した主な副作用は、中咽頭カンジダ症[レルベア100群3例(1%)、アドエア250群3例(1%)]、口腔カンジダ症[レルベア100群2例(<1%)、アドエア250群6例(2%)]等であった。試験中止または試験薬剤の投与中止に至った有害事象は、レルベア100群5例(2%)、アドエア250群1例(<1%)で報告された。死亡に至った有害事象はレルベア100群1例(<1%)であったが、試験薬剤との関連なしと判断された。

増悪頻度の抑制効果
レルベアはビランテロールに比べ、
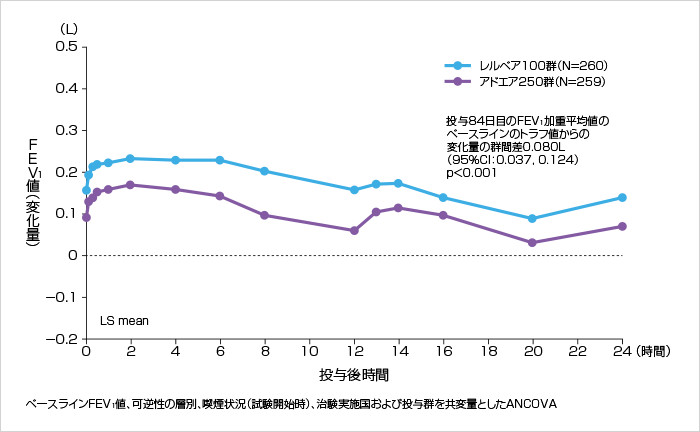
中等度または重度のCOPDの年間増悪発現頻度を21%有意に低下させました(p=0.024: 負の二項回帰モデル)。
中等度または重度のCOPDの年間増悪発現頻度(ITT)[第III相試験:海外データ(主要評価項目)]
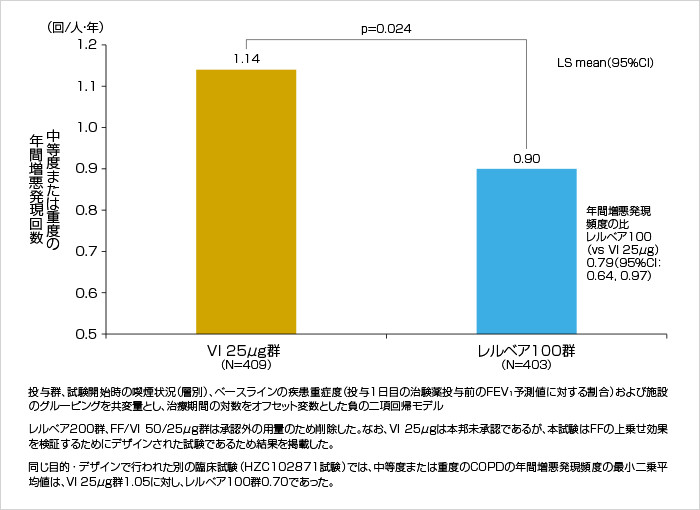
承認時評価資料より作図
HZC102970試験
目的
COPD患者を対象に、レルベア100、レルベア200、フルチカゾンフランカルボン酸エステル(FF)/ビランテロール(VI)50/25μg、またはVI 25μgをそれぞれ1日1回、52週間吸入投与したときの有効性および安全性を比較検討し、FFの上乗せによるCOPDの増悪リスク低下への影響を検証する。
対象
10pack-years※1以上の喫煙歴があり、サルブタモール吸入後の1秒量(FEV1)/努力性肺活量 (FVC)比が0.70以下、かつFEV1が予測値の70%以下であり、試験開始前12ヵ月以内に中等度または重度のCOPDの増悪※2歴を1回以上有する、40歳以上のCOPD患者1,633例
※1 1日1箱(20本)を10年間続けた状態
※2 中等度または重度のCOPDの増悪の定義:全身性/経口ステロイド薬、抗生物質の投与および/または入院を必要とするCOPD症状
方法
多施設共同・層別割付・無作為化・二重盲検・並行群間比較試験。ベースラインの症状を安定させるため、4週間の前観察期間に非盲検でアドエア250を1日2回吸入投与した。その後、レルベア100、レルベア200、FF/VI 50/25μg、またはVI 25μgを1日1回朝、それぞれエリプタを用いて52週間吸入投与した。
評価項目
有効性評価項目…
主要評価項目 : 中等度または重度のCOPDの年間増悪発現頻度
副次評価項目 : 最初の中等度または重度のCOPDの増悪発現までの時間、全身性/経口ステロイド薬を必要とするCOPDの年間増悪発現頻度、投与52週目におけるFEV1トラフ値のベースラインからの変化量
その他の評価項目: 重度のCOPDの年間増悪発現頻度等
安全性評価項目…
有害事象・肺炎の発現頻度、血液学的検査および血液生化学検査、バイタルサイン、心電図等
解析計画
中等度または重度のCOPDの年間増悪発現頻度は、ITT集団を対象に負の二項分布を仮定した一般化線形モデルを用いて解析した。最初の中等度または重度のCOPDの増悪発現までの時間は、ITT集団を対象にCox比例ハザードモデルを用いて解析した。
承認時評価資料
本邦において、レルベア200は「慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解」に承認されていない。また、FF/VI 50/25μgおよびVI 25μgは承認されていない。
本試験における安全性[安全性評価項目]
副作用の発現頻度はVI25μg群15%(63/409例)、FF/VI 50/25μg群20%(84/412例)、レルベア100群17%(70/403例)、レルベア200群20%(80/409例)であった。いずれかの群で3%以上に発現した主な副作用は、口腔カンジダ症[VI 25μg群23例(6%)、FF/VI 50/25μg群28例(7%)、レルベア100群32例(8%)、レルベア200群34例(8%)]、中咽頭カンジダ症[VI 25μg群2例(<1%)、FF/VI 50/25μg群14例(3%)、レルベア100群10例(2%)、レルベア200群5例(1%)]であった。試験中止または試験薬剤の投与中止に至った有害事象は、VI 25μg群25例(6%)、FF/VI 50/25μg群30例(7%)、レルベア100群36例(9%)、レルベア200群32例(8%)であった。死亡に至った有害事象は14例[VI 25μg群4例(<1%)、FF/VI 50/25μg群7例(2%)、レルベア100群3例(<1%)]で報告されたが、いずれも試験薬剤との関連なしと判断された。なお、注目すべき有害事象として、肺炎はVI 25μg群11例(3%)、FF/VI 50/25μg群18例(4%)、レルベア100群24例(6%)、レルベア200群19例(5%)にみられた。
承認時評価資料
同じ目的・デザインで行われた別の臨床試験(HZC102871試験)において、副作用の発現頻度は、VI 25μg群12%(50/409例)、FF/VI 50/25μg群21%(85/408例)、レルベア100群16%(64/403例)、レルベア200群15%(60/402例)であった。いずれかの群で3%以上に発現した主な副作用は、口腔カンジダ症[VI 25μg群14例(3%)、FF/VI 50/25μg群32例(8%)、レルベア100群29例(7%)、レルベア200群29例(7%)]、中咽頭カンジダ症[VI 25μg群2例(<1%)、FF/VI 50/25μg群11例(3%)、レルベア100群6例(1%)、レルベア200群5例(1%)]であった。試験中止または試験薬剤の投与中止に至った有害事象は、VI 25μg群22例(5%)、FF/VI 50/25μg群26例(6%)、レルベア100群29例(7%)、レルベア200群30例(7%)で報告された。死亡に至った有害事象は、VI 25μg群4例(<1%)、FF/VI 50/25μg群7例(2%)、レルベア100群5例(1%)、レルベア200群13例(3%)で報告されたが、いずれも試験薬剤との関連なしと判断された。
レルベアの効能・効果(抜粋)
レルベア100エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
レルベアの用法・用量(抜粋)
慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解:
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
レルベアの使用上の注意(抜粋)
2. 重要な基本的注意
(1) 本剤は既に起きている気管支喘息の発作又は慢性閉塞性肺疾患の増悪を速やかに軽減する薬剤ではないので、毎日規則正しく使用するよう患者を指導すること。
(9) 過度に本剤の使用を続けた場合、不整脈、場合により心停止を起こすおそれがあるので、用法・用量を超えて投与しないよう注意すること。(「過量投与」の項参照)
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。