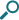製品特性
気管支喘息に対する効果

24時間の呼吸機能改善効果
レルベアは1日1吸入で、 24時間を通じて
呼吸機能の改善が認められました。
投与後0~24時間のFEV1値の推移─変化量─ (投与24週目)(ITT)
[第III相国際共同試験(主要評価項目)]
承認時評価資料
O'Byrne PM et al:Eur Respir J 2014;43(3), 773-782
HZA106829試験
目的
持続型気管支喘息患者を対象に、レルベア200またはフルチカゾンフランカルボン酸エステル(FF)200μgをそれぞれ1日1回、24週間吸入投与し、有効性および安全性を比較検討する。また、フルチカゾンプロピオン酸エステル(FP)500μgを1日2回、24週間吸入投与し、有効性および安全性を比較検討する。
対象
FP 1,000μg/日、サルメテロール/FP 100/500μg/日またはそれらと同等量で治療されており、症状のある12歳以上の持続型気管支喘息患者586例(日本人36例を含む)
方法
多施設共同・層別割付・無作為化・二重盲検・ダブルダミー・実薬対照・並行群間比較試験。レルベア200またはFF 200μgを1日1回夜にエリプタを用いて、あるいはFP 500μgを1日2回朝夜にディスカスを用いて、いずれも24週間吸入投与した。
評価項目
有効性評価項目…
複合主要評価項目: 投与24週目におけるFEV1トラフ値の変化量、投与24週目における投与後0~24時間のFEV1加重平均値
副次評価項目 : 24時間発作治療薬未使用日数の割合の変化量、24時間無症状日数の割合の変化量、QOL評価[Asthma Quality of Life Questionnaire+12(AQLQ+12)]の変化量
その他の評価項目: 投与1~12週目および投与1~24週目における毎朝および毎夜のピークフロー値の変化量
安全性評価項目…
有害事象、重度喘息増悪、口腔咽頭検査、臨床検査値、24時間尿中コルチゾール排泄量、バイタルサイン、12誘導心電図
解析計画
複合主要評価項目および副次評価項目は、ITT集団を対象にANCOVAモデルを用いて解析した。
承認時評価資料
O'Byrne PM et al:Eur Respir J 2014;43(3), 773-782
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者には、グラクソ・スミスクライン(株)の社員が含まれた。
HZA106829試験における安全性 [安全性評価項目]
治療期間及び後観察期間で、副作用は、レルベア200群9%(17/197例)、FF200µg群4%(8/194例)、FP500µg 1日2回群8%(16/195例)に発現した。主な副作用(2例以上)は、FF200µg群では認められず、レルベア200群では発声障害3%(5例)、口腔カンジダ症、中咽頭カンジダ症各2%(4例)、口内乾燥1%(2例)、FP500µg 1日2回群では口腔カンジダ症、発声障害各2%(3例)、中咽頭カンジダ症1%(2例)であった。重篤な有害事象は9例(レルベア200群6例、 FF200µg群1例、FP500µg 1日2回群2例)に発現し、そのうち2例(レルベア200群:心房細動、FP500µg 1日2回群:喀血)が副作用と判定された。FF200µg群において、重篤な有害事象(喘息)により1例が試験薬剤または試験を中止したが、試験薬剤との関連はなしと判定された。レルベア200群の3例及びFP500µg 1日2回群の2例が副作用により試験薬剤の投与中止または試験中止に至った。死亡に至った有害事象の報告はなかった。
承認時評価資料
O'Byrne PM et al:Eur Respir J 2014;43(3), 773-782
レルベアの効能・効果(抜粋)
レルベア100エリプタ
気管支喘息(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
慢性閉塞性肺疾患(慢性気管支炎・肺気腫)の諸症状の緩解(吸入ステロイド剤及び長時間作動型吸入β2刺激剤の併用が必要な場合)
レルベアの用法・用量(抜粋)
気管支喘息:
通常、成人にはレルベア100エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてレルベア200エリプタ1吸入(ビランテロールとして25μg及びフルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
レルベアの使用上の注意(抜粋)
2. 重要な基本的注意
(1) 本剤は既に起きている気管支喘息の発作又は慢性閉塞性肺疾患の増悪を速やかに軽減する薬剤ではないので、毎日規則正しく使用するよう患者を指導すること。
6 .小児等への投与
小児等に対する安全性は確立していない(使用経験がない)。
フルチカゾンプロピオン酸エステルの用法・用量
成人には、フルチカゾンプロピオン酸エステルとして通常1回100μgを1日2回吸入投与する。
なお、症状により適宜増減するが、1日の最大投与量は800μgを限度とする。
小児には、フルチカゾンプロピオン酸エステルとして通常1回50μgを1日2回吸入投与する。
なお、症状により適宜増減するが、1日の最大投与量は200μgを限度とする。
サルメテロールの用法・用量
成人にはサルメテロールとして1回50μgを1日2回朝および就寝前に吸入投与する。
小児にはサルメテロールとして1回25μgを1日2回朝および就寝前に吸入投与する。なお、症状に応じて1回50μg1日2回まで増量できる。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。