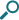薬物動態
血中濃度
健康成人
日本人健康成人6例にラミクタール25~200mgを単回経口投与した時、投与後1.7~2.5時間でCmaxに達し、t1/2は約31~38時間でした。Cmax及びAUC0-∞は投与量の増加に伴い増大しました。また、健康成人6例にラミクタール50mgを1日2回10日間反復経口投与した時、血漿中ラモトリギン濃度は投与6日目に定常状態に達しました。
健康成人にラミクタール25~200mgを単回経口投与した時の血漿中濃度推移
[承認時評価資料(2.7.2.2.2.1.1.)]
健康成人にラミクタール25~200mgを単回経口投与した時のラモトリギンの薬物動態パラメータ
平均値±標準偏差
[承認時評価資料(2.7.2.2.2.1.1.)]
てんかん患者(外国人データを含む)
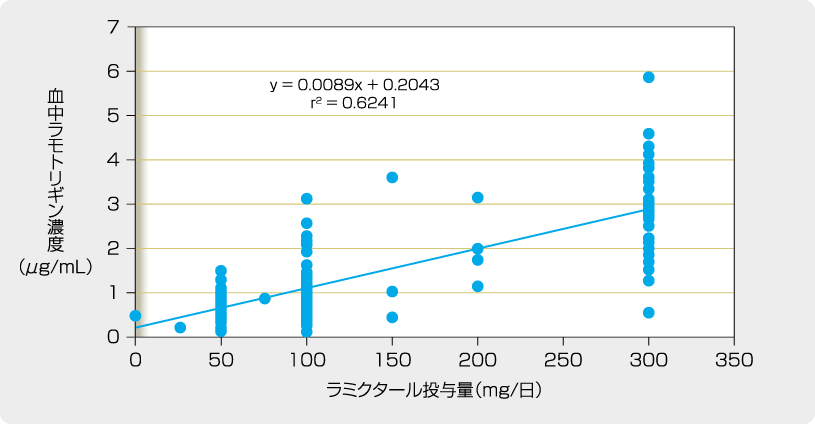
成人てんかん患者を対象とした国内臨床試験において、ラミクタール200mgを投与した時の血中ラモトリギン濃度は、バルプロ酸ナトリウムを併用し、本剤のグルクロン酸抱合を誘導する薬剤を併用しない場合は9.6μg/mL、バルプロ酸ナトリウムを併用せず、本剤のグルクロン酸抱合を誘導する薬剤を併用した場合は2.2μg/mLでした。
成人又は小児てんかん患者を対象とした国内臨床試験において、既存の抗てんかん薬の投与を受けている患者にラミクタールを投与した時の定常状態における血中ラモトリギン濃度、並びに成人てんかん患者を対象とした日韓共同試験において、抗てんかん薬を併用しなかった時の日本人患者での定常状態における血中ラモトリギン濃度を以下に示します。併用抗てんかん薬によりラミクタールの維持用量(【用法及び用量】の項参照)は異なりますが、同様の血中濃度が示されました。また、ラミクタールの投与前後で併用抗てんかん薬の血中濃度に顕著な差は認められませんでした。
グルクロン酸転移酵素を誘導する抗てんかん薬を併用した時のラモトリギンのt1/2は約13時間でした(外国人データ)。なお、外国人健康成人にバルプロ酸ナトリウムを併用した時のラモトリギンのt1/2は約70時間でした。
成人てんかん患者における血中濃度
a:カルバマゼピン、フェノバルビタール、プリミドン、フェニトイン
b:中央値(最小値~最大値)
c:検出下限未満であった1サンプルを除く
[承認時評価資料]
小児てんかん患者における血中濃度
a:カルバマゼピン、フェノバルビタール、プリミドン、フェニトイン
b:中央値(最小値〜最大値)
[承認時評価資料(大田原 俊輔 他:てんかん研究 25:425-440, 2008)]
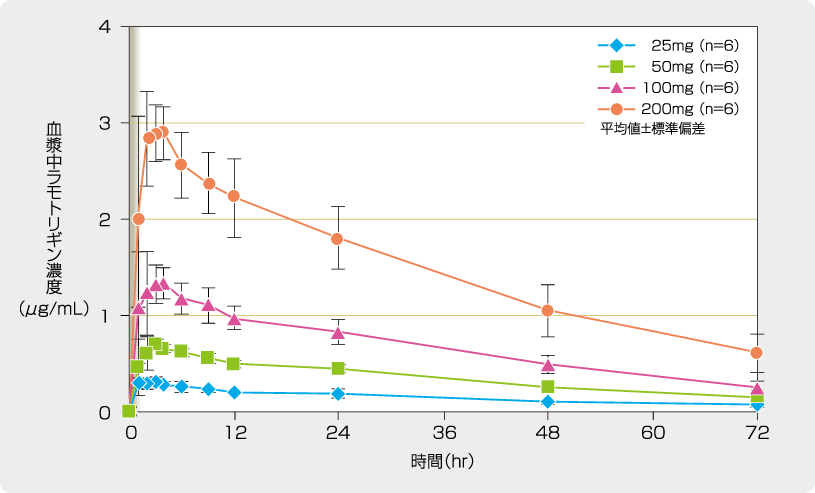
成人てんかん患者を対象とした後期第II相試験において、血中ラモトリギン濃度は投与量の増加に伴って上昇し、ラモトリギンの薬物動態は線形を示しました(n=103)。
ラミクタールの投与量に対する血中濃度分布
[承認時評価資料(村崎 光邦 他:臨床精神薬理 11:99-115, 2008)]
小児てんかん患者を対象とした第III相試験でも、ラモトリギンの血中動態はほぼ線形を示すと考えられます。
ラミクタールの投与量に対する血中濃度分布
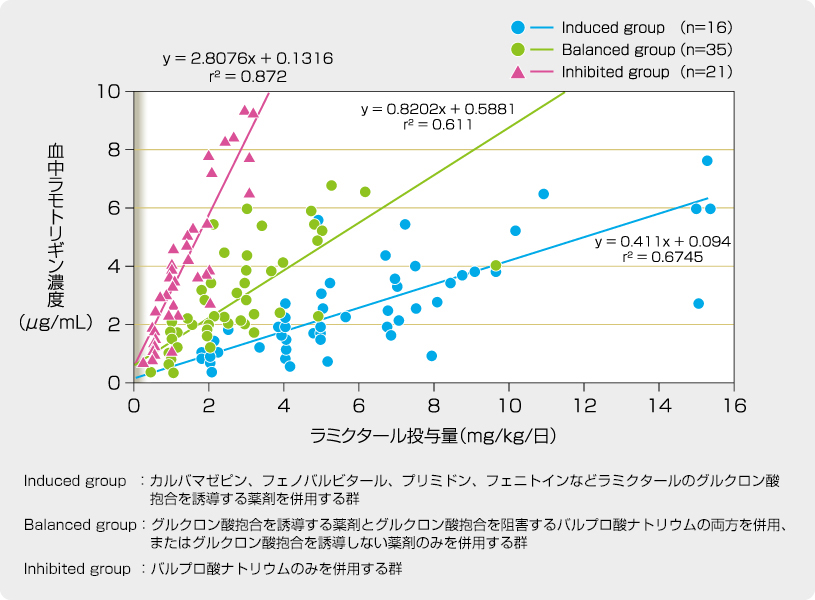
[承認時評価資料(大田原 俊輔 他:てんかん研究 25:425-440, 2008)]
生物学的利用率(外国人データ)
健康成人8例にラミクタール75mgを単回経口投与した時の生物学的利用率は97.6%でした。
[承認時評価資料(UK13試験)]
食事の影響(外国人データ)
健康成人12例にラミクタール150mgを空腹時及び食後に単回経口投与した時、食後投与では空腹時に比べ血漿中ラモトリギンのTmaxは遅延しましたが、空腹時投与に対する食後投与時のAUC0-168及びCmaxの平均値の比の95%信頼区域は、いずれも生物学的同等性の許容範囲(0.8~1.25)内でした。
空腹時及び食後に単回経口投与した時の血漿中濃度推移
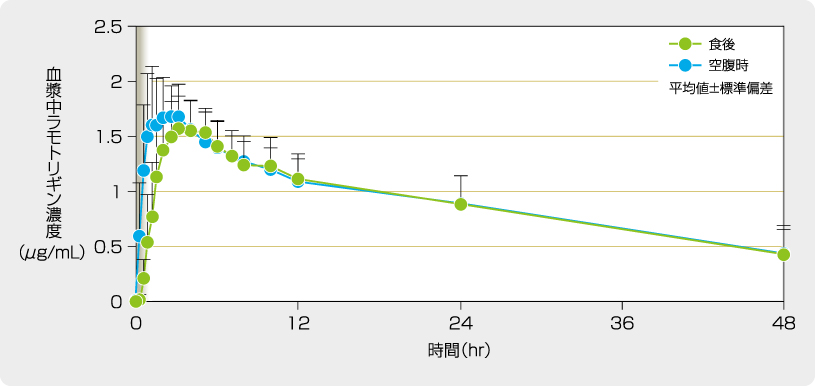
[承認時評価資料(UK64試験)]
空腹時及び食後に単回経口投与した時のラモトリギンの薬物動態パラメータ
平均値±標準偏差
[承認時評価資料(UK64試験) ]
高齢者(外国人データ)
高齢者12例(65歳以上、クレアチニンクリアランス:平均61mL/min)にラミクタール150mgを単回経口投与した時、ラモトリギンのCmax、AUC0-∞、t1/2及びCL/Fの平均値(標準偏差)は各々2.35(0.40)μg/mL、93.8(21.0)μg・hr/mL、31.2(5.4)時間及び0.396(0.063)mL/min/kgでした。
なお、健康成人男性にラミクタール150mgを単回経口投与した時のCmax、AUC0-∞、t1/2及びCL/Fの平均値(標準偏差)は各々2.45(0.18)μg/mL、117.30(24.61)μg・hr/mL、31.2(6.4)時間、0.313(0.087)mL/min/kgでした。
高齢者におけるラモトリギンの薬物動態パラメータ
平均値±標準偏差
[承認時評価資料(Posner J et al:J Pharm Med 1:121-128, 1991)]
肝機能障害患者(外国人データ)
健康成人12例及び肝硬変患者24例にラミクタール100mgを単回経口投与した時のラモトリギンの薬物動態パラメータを以下に示します。
中等度肝硬変患者においてCmaxの低下がみられたものの、他のパラメータでは健康成人との間に顕著な差はみられませんでした。重度肝硬変患者では健康成人と比較してCmax及びTmax以外のパラメータに差がみられ、AUC0-∞及びt1/2は腹水なしで約2倍、腹水ありで約4倍増加し、CL/Fは腹水なしで2/3、腹水ありで1/3に減少しました。
肝硬変患者におけるラモトリギンの薬物動態パラメータ
中央値(範囲)
[承認時評価資料(Marcellin P et al:Br J Clin Pharmacol 51:410-414, 2001)]
[解説:Child-Pugh分類(肝硬変のステージ分類)]
Child-Pugh分類
Child-Pugh分類 Grade A:5~6点 Grade B:7~9点 Grade C:10~15点
[Pugh RNH et al:Br J Surg 60:289-296, 1973]
腎機能障害患者(外国人データ)
腎機能障害患者12例(クレアチニンクリアランス:平均13mL/min)及び透析患者6例(血清クレアチニン:平均854μmol/L)にラミクタール100mgを単回経口投与した時、ラモトリギンのt1/2は健康成人のそれぞれ約1.6倍及び約2.2倍に遅延し、AUCは腎機能障害患者で約1.8倍に増加しました。また、血液透析を4時間実施した場合、体内に存在するラモトリギンの約20%が透析により除去されました。
腎機能障害患者におけるラモトリギンの薬物動態パラメータ
平均値±標準偏差
[承認時評価資料(UK107試験、Fillastre JP et al:Drugs Exp Clin Res 19:25-32, 1993)]
服用方法毎の血中濃度の推移(外国人データ)
健康成人男女12例を対象に、非盲検、無作為化、4期クロスオーバー法でラミクタール100mgチュアブル・ディスパーシブル錠をそのまま服用(咀嚼して服用)、水で服用、水に懸濁して服用した時の薬物動態を検討したところ、チュアブル・ディスパーシブル錠を水で服用した時のTmaxは、水に懸濁及びそのまま服用した時のTmaxと比較して中央値で1時間の遅延が認められたものの、他の薬物動態パラメータに明らかな変化は認められませんでした。
チュアブル・ディスパーシブル錠服用後の血中濃度推移
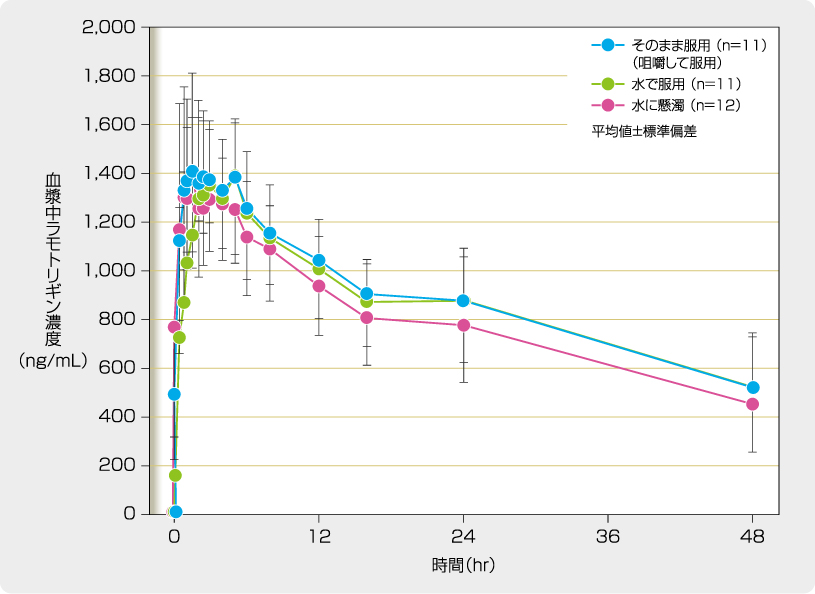
[承認時評価資料(UK134V試験)]
チュアブル・ディスパーシブル錠服用後の薬物動態パラメータ
[承認時評価資料(UK134V試験)]
ラミクタールの「警告」、「禁忌」、「効能又は効果」、「用法及び用量」、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」等については 電子添文をご参照ください。
分布
分布容積(健康成人)
69.8~91.0L(1.15~1.49L/kg)
[承認時評価資料(2.7.2.2.2.1.1.)]
組織移行性(サル)
雌雄サルにラモトリギンのイセチオン酸塩を5~20/15mg/kg/日(投与4日以降、順次20mg/kg/日から15mg/kg/日に減量)を14日間静脈内投与した時の未変化体の組織内分布は広範であり、脳内未変化体濃度は血漿中濃度よりも高値でした。
[承認時評価資料(2.6.4.3.4.)]
胎盤・胎児移行性(外国人データ)
9例の妊婦(うち5例はラミクタール単剤投与)の出産時の臍帯血中濃度/母体の血漿中濃度比中央値は0.9(範囲:0.6~1.3)であり、ラモトリギンの胎盤通過性は高いことが示唆されました。出産72時間後での新生児の血漿中濃度は臍帯血中濃度の75%(中央値、範囲:50~100%)で、新生児におけるラモトリギンの血中からの消失は緩やかでした。
[承認時評価資料(Ohman l et al:Epilepsia 41:709-713, 2000)]
乳汁移行性(外国人データ)
ラミクタール(平均投与量:386.5mg/日)が7日間以上単剤投与された授乳中の婦人26例における乳汁中濃度/母体血漿中濃度比平均値は0.413〔95%信頼区間(CI):0.330~0.496〕でした。すなわち、ラモトリギンは乳汁中に移行し、乳児に対する投与量は0.51mg/kg/日(95%CI:0.37~0.65)に相当します。なお、乳児の血漿中濃度は、母体の血漿中濃度の18.3%(95%CI:9.5~27.0)でした。
[承認時評価資料(Newport DJ et al:Pediatrics 122:e223-e231, 2008)]
血漿蛋白結合率(in vitro)
53.1~56.2%(ヒト血漿、濃度1~10μg/mL)
[承認時評価資料(2.6.4.4.3.)]
血球移行性(in vitro)
健康成人男性に14C-ラモトリギン約240mg単回経口投与後の放射能の血液/血漿比は1.16(平均値)でした。
[承認時評価資料(2.6.4.4.4.)]
ラミクタールの「警告」、「禁忌」、「効能又は効果」、「用法及び用量」、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」等については 電子添文をご参照ください。
代謝・排泄
代謝・排泄(外国人データ)
ラモトリギンは主としてグルクロン酸抱合により代謝されます。健康成人6例に14C-ラモトリギン240mg(15μCi)を単回経口投与した時、投与後168時間までに糞中に約2%、尿中に約94%が排泄されました。尿中へは主にラモトリギン-N2-グルクロン酸抱合体(M1)(約71%)として排泄され、以下未変化体(M3)(10%)、ラモトリギン-N5-グルクロン酸抱合体(M2)(5~10%)及びラモトリギン-N2-メチル体(M4)(0.14%)の順でした。
ラモトリギンの推定代謝経路
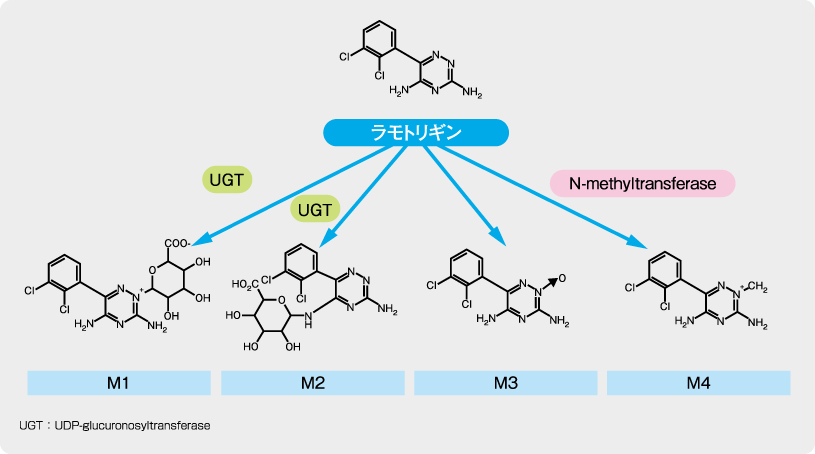
[承認時評価資料(2.6.4.5.4.)]
ラミクタールの「警告」、「禁忌」、「効能又は効果」、「用法及び用量」、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」等については 電子添文をご参照ください。
相互作用
ラモトリギンは主としてグルクロン酸転移酵素(主にUGT1A4)で代謝されます。
併用注意(併用に注意すること)
[ ]内は電子添文項目番号
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| バルプロ酸ナトリウム [7.2、7.3、16.7.1、16.7.2参照] |
本剤の消失半減期が約2倍延長するとの報告がある。 | 肝におけるグルクロン酸抱合が競合する。 |
本剤のグルクロン酸抱合を誘導する薬剤 フェニトイン [7.2、7.3、16.7.1、16.7.2参照] |
本剤の血中濃度が低下する。 | 肝における本剤のグルクロン酸抱合が促進される。 |
| アタザナビル+リトナビル [16.7.2参照] |
アタザナビル及びリトナビル両剤と本剤を併用した場合に本剤の血中濃度が低下したとの報告がある。本剤維持用量投与中にアタザナビルとリトナビルを投与開始又は投与中止する場合には、本剤の用量調節を考慮すること。 | 肝における本剤のグルクロン酸抱合が促進される。 |
| カルバマゼピン [6.参照] |
本剤とカルバマゼピンの併用により、めまい、失調、複視、霧視、嘔気等が発現したという報告があり、通常、これらの症状はカルバマゼピンの減量により回復する。 | 機序不明 |
| リスペリドン [16.7.2参照] |
本剤とリスペリドンの併用時には、それぞれの単独投与時に比較して、傾眠の報告が多いとの報告がある。 | 機序不明 |
| 経口避妊薬(卵胞ホルモン・黄体ホルモン配合剤) [16.7.2参照] |
本剤とエチニルエストラジオール・レボノルゲストレル配合剤との併用において、以下の報告がある。 1) 本剤の血中濃度が減少したとの報告があるので、本剤維持用量投与中に経口避妊薬を投与開始又は投与中止する場合には、本剤の用量調節を考慮すること。 2) レボノルゲストレルの血中濃度が減少し、血中卵胞ホルモン(FSH)及び黄体形成ホルモン(LH)が上昇し、エストラジオールが僅かに上昇したとの報告がある。 |
1) 肝における本剤のグルクロン酸抱合が促進される。 2)機序不明 |
ラミクタールの「警告」、「禁忌」、「効能又は効果」、「用法及び用量」、「効能又は効果に関連する注意」、「用法及び用量に関連する注意」等については 電子添文をご参照ください。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。