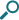吸入操作に関するデータ
91%の喘息患者さんが、エリプタの使いやすさについて簡単だと評価しました
複合主要評価項目の結果【第III相国際共同試験】
| レルベア100群 | FF 100μg群 | プラセボ群 | |
| FEV1トラフ値の変化量(投与12週目)(L)[複合主要評価項目] | |||
| 例数 | n=200 | n=203 | n=193 |
| 変化量 LS mean(SE) | 0.368 (0.0304) | 0.332 (0.0302) | 0.196 (0.0310) |
| プラセボ群との差 (95%CI) p値 |
0.172 (0.087, 0.258) <0.001 |
0.136 (0.051, 0.222) 0.002 |
ー |
| FF 100μg群との差 (95%CI) p値 |
0.036 (-0.048, 0.120) 0.405 |
ー | ー |
| 投与後0~24時間のFEV1加重平均値の変化量(投与12週目)(L)[複合主要評価項目] | |||
| 例数 | n=108 | n=106 | n=95 |
| 変化量 LS mean(SE) | 0.513 (0.0430) | 0.398 (0.0432) | 0.212 (0.0456) |
| プラセボ群との差 (95%CI) p値 |
0.302 (0.178, 0.426) <0.001 |
0.186 (0.062, 0.310) 0.003 |
ー |
| FF 100μg群との差 (95%CI) p値 |
0.116 (-0.005, 0.236) 0.060 |
ー | ー |
安全性【第III相国際共同試験】
副作用の発現頻度は、レルベア100群7%(14/201例)、FF 100μg群5%(10/205例)、プラセボ群1%(3/203例)であった。レルベア100群ではプラセボ群に比べて24時間尿中コルチゾール排泄量が減少した。主な副作用は、口腔カンジダ症[レルベア100群4例(2%)、FF 100μg群2例(<1%)]、中咽頭カンジダ症[レルベア100群1例(<1%)、FF 100μg群2例(<1%)]、発声障害[レルベア100群2例(<1%)]、鼻出血[レルベア100群2例(<1%)]であった。治療期間中の重篤な有害事象はFF 100μg群1例で報告されたが、試験薬剤との関連はないと判断された。本試験において、死亡に至った有害事象の報告はなかった。試験薬剤の投与中止または試験中止に至った有害事象は3例[レルベア100群2例(<1%)、プラセボ群1例(<1%)]で報告された。そのうち、レルベア100群1例(発疹)、プラセボ群1例(浮動性めまい、呼吸困難、頭痛、非心臓性胸痛)が試験薬剤と関連があると判断された。
目的
持続型気管支喘息患者を対象に、レルベア100またはフルチカゾンフランカルボン酸エステル(FF)100μgをそれぞれ1日1回、12週間吸入投与し、有効性及び安全性を比較検討する。
対象
フルチカゾンプロピオン酸エステル(FP)200~500μg/日、サルメテロール/FP 100/200μg/日またはそれらと同等量で治療されており、症状のある12歳以上の持続型気管支喘息患者609例(日本人50例を含む)
方法
多施設共同・層別割付・無作為化・二重盲検・プラセボ対照・並行群間比較試験。
レルベア100、FF 100μgまたはプラセボを1日1回夜に、それぞれエリプタを用いて12週間吸入投与した。
評価項目
[ 有効性評価項目 ]
複合主要評価項目:
投与12週目におけるFEV1トラフ値の変化量、投与12週目における投与後0~24時間のFEV1加重平均値
副次評価項目:
24時間発作治療薬未使用日数の割合の変化量、24時間無症状日数の割合の変化量、QOL評価[Asthma Quality of Life Questionnaire+12(AQLQ+12)]の変化量、効果不十分により治験を中止した被験者数
その他の評価項目:
吸入器使用に関する評価 など
治療開始時に担当医師またはそれに代わるスタッフがエリプタの正しい操作方法について患者に指導を行い、エリプタの操作状況についてアンケートを実施した。
[ 安全性評価項目 ]
有害事象、重度喘息増悪、口腔咽頭検査、臨床検査値、24時間尿中コルチゾール排泄量、バイタルサイン、12誘導心電図
解析計画
FEV1トラフ値のベースライン値からの平均変化量及び投与12週目の投与後0~24時間のFEV1加重平均値は、ITT集団を対象にベースライン値、地域、性別、年齢及び投与群を共変量とするANCOVAモデルを用いて解析した。
(本邦においてレルベアの12歳以上15歳未満への投与及びFF100μg、FP500μgは承認されていない)レルベア承認時評価資料
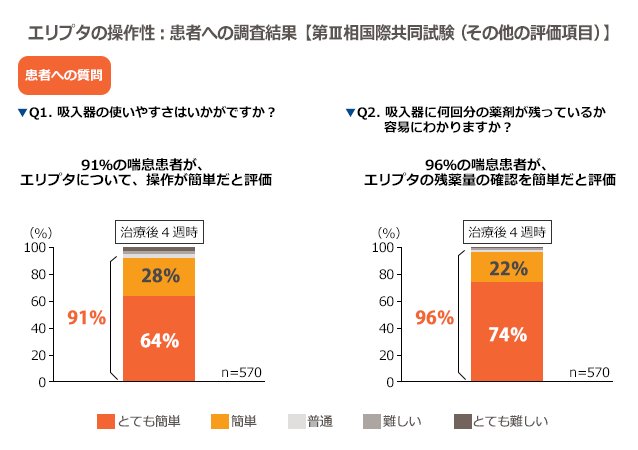
98%のCOPD患者が最初からエリプタを正しく吸入操作でき、6週間後時点でも98%の患者がエリプタを正しく吸入操作できました
複合主要評価項目の結果
【第III相(DB2114418)試験:海外データ】
投与12週目の投与後3時間のEET(ITT集団)
| プラセボ群 (n=117) |
UMEC群 (n=37) |
VI群 (n=54) |
アノーロ群 (n=115) |
|
|---|---|---|---|---|
| 変化量 LS mean (SE) | 0.1 (16.66) | 25.1 (30.18) | 30.7 (24.79) | 69.5 (17.09) |
| プラセボに対する差 (95%CI) p値 |
ー | 25.0 (-41.0, 91.0) p=0.456 |
30.6 (-26.8, 88.0) p=0.295 |
69.4 (24.5, 114.4) p=0.003 |
解析は、歩行速度、平均歩行速度、試験薬投与期間、治療群、Visit、喫煙状況、施設グループ、Visitと歩行速度の交互作用、Visitと平均歩行速度の交互作用、およびVisitと治療群の交互作用を共変量とした反復測定モデルを用いて行った。
投与12週目のFEV1トラフ値(mL)(ITT集団)
| プラセボ群 (n=119) |
UMEC群 (n=38) |
VI群 (n=56) |
アノーロ群 (n=117) |
|
|---|---|---|---|---|
| 変化量 LS mean(SE) | -43 (15.6) | 101 (26.7) |
69 (22.2) |
200 (15.6) |
| プラセボに対する差 (95%CI) p値 |
ー | 144 (86, 203) p<0.001 |
112 (61, 163) p<0.001 |
243 (202, 284) p<0.001 |
解析は、試験薬投与期間ベースライン、平均ベースライン、治験薬投与期間、治療群、Visit、喫煙状況、施設グループ、Visitと治験薬投与期間ベースラインの交互作用、Visitと平均ベースラインの交互作用、およびVisitと治療群の交互作用を共変量とした反復測定モデルを用いて行った。
安全性【第III相(DB2114418)試験:海外データ】
治療期間中および後解析期間中に試験薬と関連があると判断された有害事象の発現率は、アノーロ群6%(8/130例)、UMEC群3%(1/40例)、VI群5%(3/64例)、プラセボ群5%(7/151例)であった。
試験薬と関連があると判断された主な有害事象(いずれかの治療群で2例以上に発現)は、動悸[アノーロ群2%(2/130例)、他0%]であった。
治療期間中および後解析期間中に試験薬と関連があると判断された重篤な有害事象は、試験薬投与期間中のVI群の1例にみられた白血球破砕性血管炎であった。
治療期間中および後解析期間中に試験中止または試験薬投与中止に至った有害事象の発現率は、アノーロ群4%(5/130例)、UMEC群3%(1/40例)、VI群6%(4/64例)、プラセボ群5%(8/151例)であった。2例以上でみられた試験中止または試験薬投与中止に至った有害事象は、呼吸困難(実薬群0~2%、プラセボ群1%)および慢性閉塞性肺疾患(実薬群0~2%、プラセボ群<1%)であった。
第1治療期間にUMEC群、第2治療期間にアノーロ群に割り付けられた1例が試験期間中に死亡した。本死亡は肺の悪性新生物および中枢神経系転移によるものであり、試験薬と関連がないと判断された。
目的
COPD患者にウメクリジニウム(UMEC)/ビランテロール(VI)を12週間投与したときの有効性を、定常式負荷シャトルウォーキングテスト(ESWT)により測定した運動持続時間(EET)及びトラフFEV1値により評価する。
対象
10pack-years以上の喫煙歴があり、サルブタモール吸入後のFEV1/努力性肺活量(FVC)比が0.70未満かつFEV1が予測値の35~70%、機能的残気量(FRC)が予測値の120%以上で40歳以上のCOPD患者307例
方法
多施設共同・無作為化・二重盲検・プラセボ対照・2期不完全ブロッククロスオーバー試験。UMEC/VI 125/25μg(UMEC/VI 125/25μg群)、UMEC/VI 62.5/25μg(アノーロ群)、UMEC 125μg(UMEC 125μg群)、UMEC 62.5μg(エンクラッセ群)、VI 25μg(VI群)またはプラセボ(プラセボ群)を12週間、それぞれエリプタを用いて1日1回朝に吸入投与した。
評価項目
[ 有効性評価項目 ]
複合主要評価項目:
投与12週目の投与後3時間に測定したEET、投与84日目の投与後24時間に測定したトラフFEV1値
副次評価項目:
投与12週目の肺容量測定[最大吸気量(IC)、FRC及び残気量(RV)](トラフ値及び投与後3時間の値)、投与12週目の投与後3時間のFEV1
その他の評価項目:
吸入器の使いやすさ等
[ 安全性評価項目 ]
有害事象の発現頻度、血液学的検査及び血液生化学的検査パラメータ、バイタルサイン(脈拍数、収縮期血圧及び拡張期血圧)及び12誘導心電図パラメータ、COPDの増悪
[ヘルスアウトカムズ]
修正Borgスケールを用いた労作時の呼吸困難の程度(EDS)
解析計画
投与12週目の投与後3時間のEET及び投与12週目のトラフFEV1値は、ITT集団を対象とし、反復測定混合モデルを用いて解析を行うこととした。吸入器の使いやすさについては、吸入操作における誤操作の有無を記録した。
UMEC/VI 125/25μg及びUMEC125μgは承認外の用量である。アノーロの有効成分であるVIの単剤での投与は、本邦で承認されていない。
[1] エンクラッセ承認時評価資料:運動耐用能試験(海外、DB2114418試験)
[2] Maltais F et al:Ther Adv Respir Dis 2014; 8(6), 169-181*
*利益相反:本試験に関わる費用は、GSKの支援を受けた。著者には、GSKが過去に講演料・研究助成金を支払った者、GSKの顧問またはCIHR/GSKの委員長を務めている者、GSKの社員・株主・自社株購入権を有する者が含まれる。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。