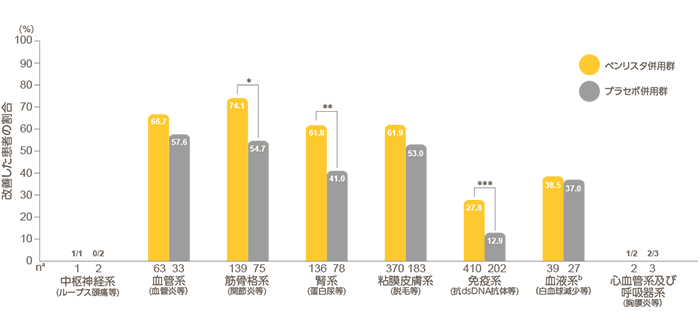
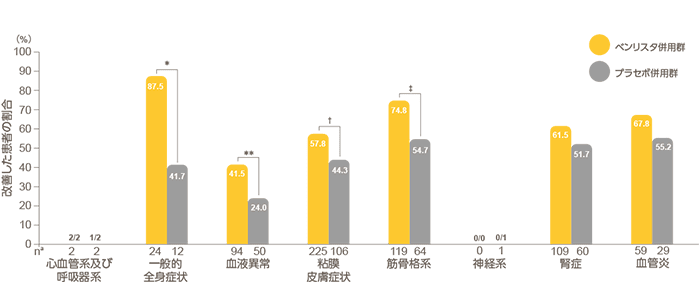
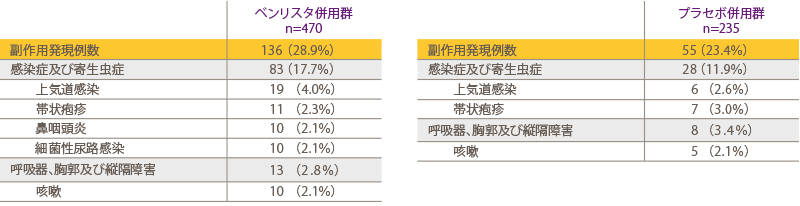
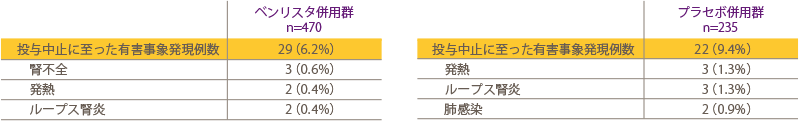
目 的
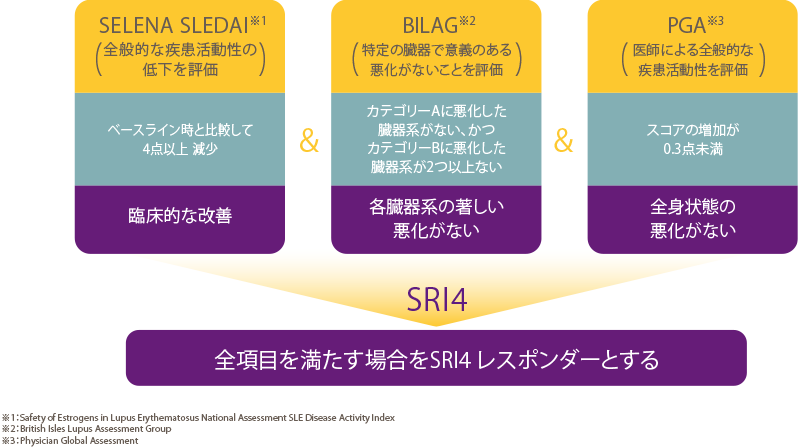
既存の標準治療に加えてベンリスタ10 mg/kgを投与したときの有効性及び安全性をプラセボと比較する。有効性については、主要評価項目である52週時のSLE responder index(SRI)4のレスポンダー※1率において、プラセボに対するベンリスタ10mg/kgの優越性を検証する。
対 象
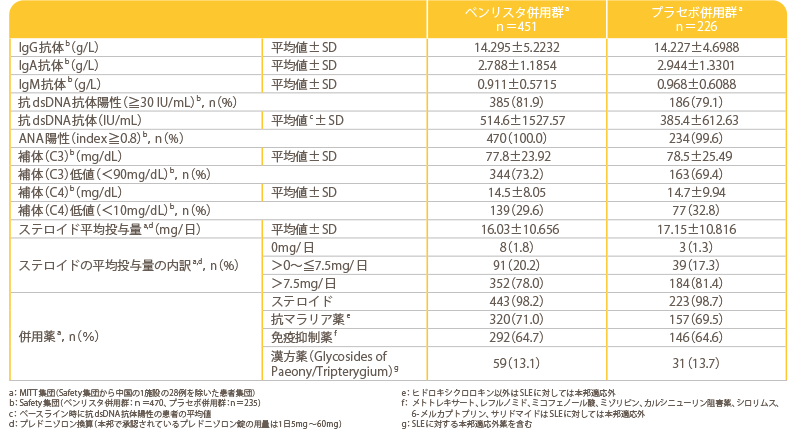
米国リウマチ学会(ACR)基準でSLEと臨床診断され、自己抗体陽性で疾患活動性を有し、既存の標準治療bを受けている18歳以上のSLE患者705例(日本人60例含む)
主な選択基準
- 18歳以上
- 米国リウマチ学会(ACR)基準でSLEと診断された患者
- 自己抗体検査で2回の陽性判定/又は抗dsDNA抗体30IU/mL以上
- 初回投与の30日以上前からSLE治療を単独又は併用で安定的に受けている患者a
主な除外基準
重症ループス腎症又は急性ループス腎炎を合併している患者
新たなSLE治療薬(ステロイドを除く)を投与された患者
治療を要するCNSループスを合併している患者(60日以内)
a:ステロイド(prednisone換算で、併用では0~40mg/日、単独では7.5mg/日)、抗マラリア薬、非ステロイド性抗炎症薬(NSAID)、免疫抑制薬・免疫調整薬(メトトレキサート、アザチオプリン、レフルノミド、ミコフェノール酸、ミゾリビン、カルシニューリン阻害薬、シロリムス、シクロホスファミド経口剤、6-メルカプトプリン、サリドマイド)
方 法
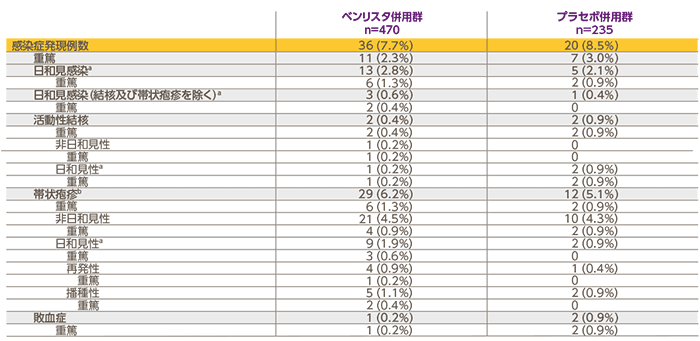
対象患者を無作為化cして既存治療+ベンリスタ群(ベンリスタ併用群、470例)又は既存治療+プラセボ群(プラセボ併用群、235例)に2:1で割り付け、既存の標準治療に上乗せして、二重盲検下でベンリスタ10mg/kg又はプラセボを初回、2週間後、4週間後、以降は4週間ごとに48週時まで静脈内投与し52週間観察した。


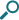


![52週時のSRI4レスポンダー率[主要評価項目:検証的な解析結果]](/content/dam/global/hcpportal/ja_JP/products-info/benlysta-new/images/benlysta-sle-eight.png)