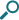製品特性
安全性
副作用発現状況(臨床検査値異常を含む)
国内臨床試験、第III相国際共同試験3試験、第III相海外臨床試験2試験および第II相海外臨床試験3試験(計9試験)において、本剤が投与された総症例2,394例中145例(6.1%)に臨床検査値異常を含む副作用が報告された。その主なものは、口腔カンジダ症24例(1.0%)、頭痛17例(0.7%)、中咽頭カンジダ症16例(0.7%)、発声障害16例(0.7%)であった(表1)。(承認時)
国内長期投与試験において、本剤が投与された総症例90例中16例(17.8%)に臨床検査値異常を含む副作用が報告された。その主なものは、発声障害6例(6.7%)、口腔カンジダ症3例(3.3%)、味覚異常2例(2.2%)であった(表2)。(承認時)
表1 気管支喘息を対象とした国内臨床試験、第III相国際共同試験3試験、第III相海外臨床試験2試験および第II相海外臨床試験3試験(計9試験※)で認められた副作用一覧
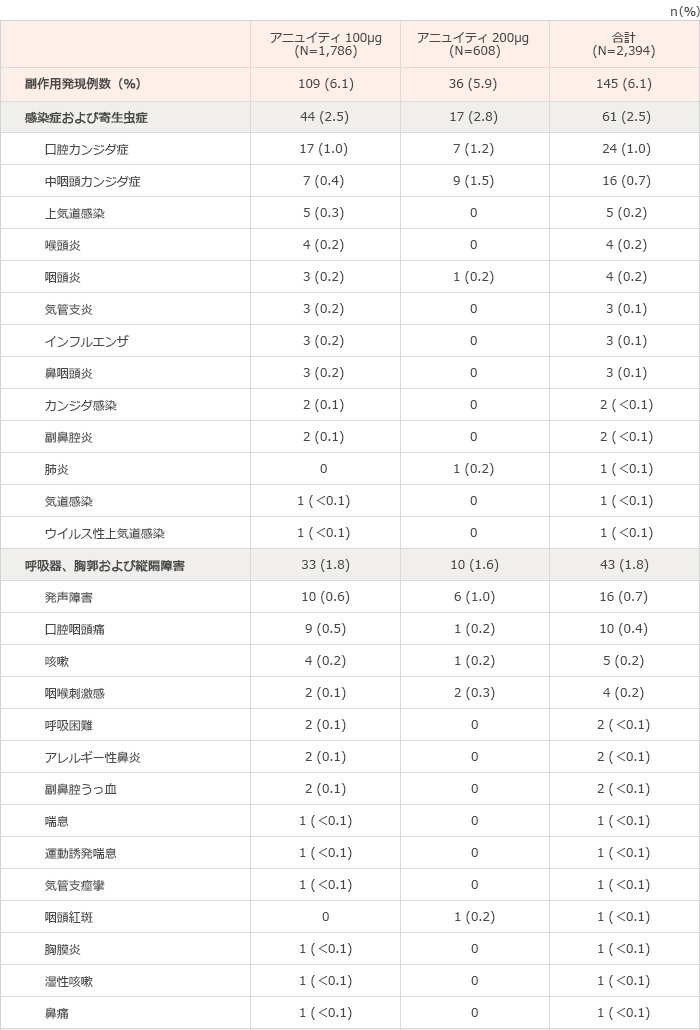
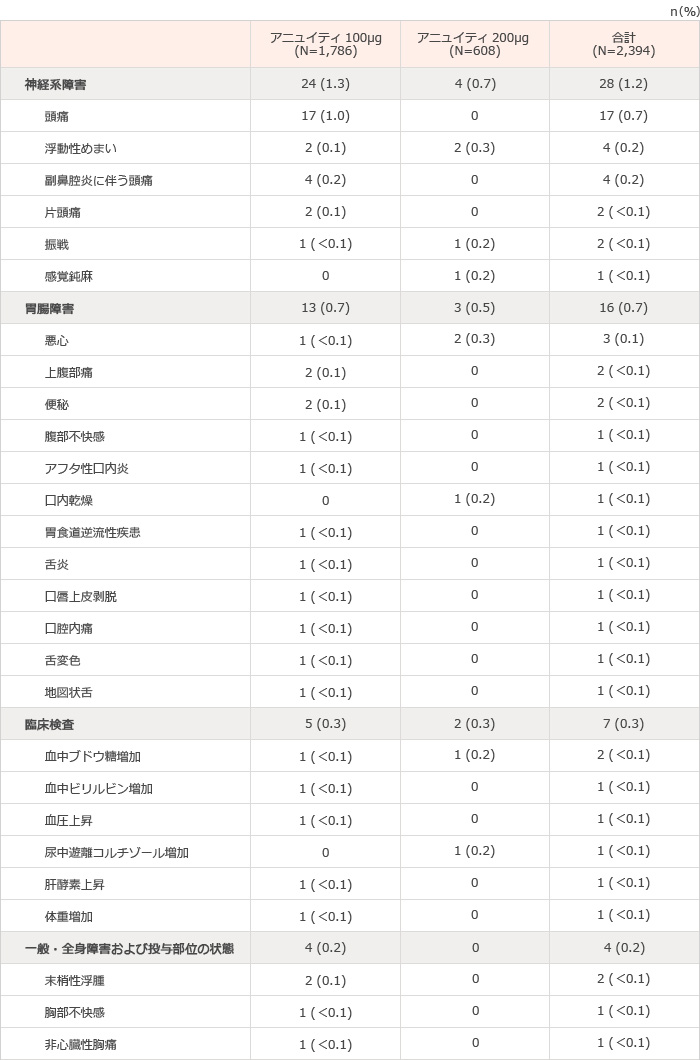
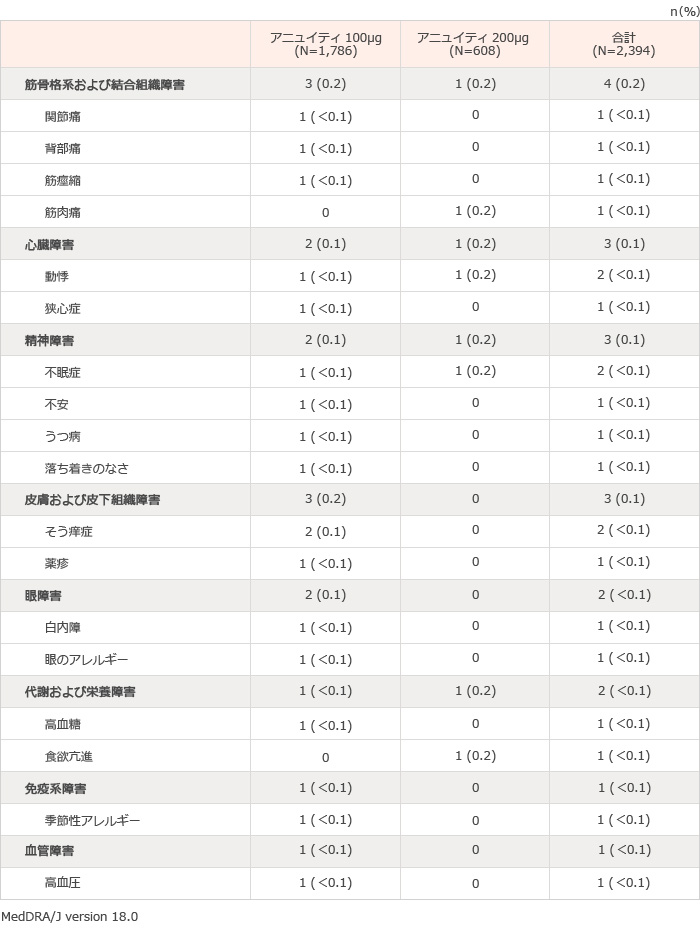
※集計対象の臨床試験:201135試験、FFA109684試験、FFA109685試験、FFA109687試験、FFA112059試験、FFA114496試験、HZA106827試験、HZA106829試験およびHZA106837試験
承認時評価資料:安全性
表2 国内長期投与試験(HZA113989試験)で認められた副作用一覧
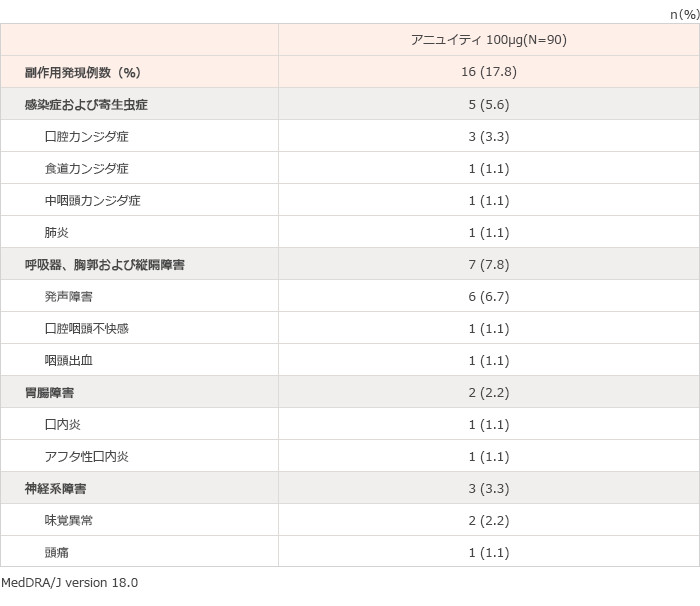
承認時評価資料:安全性
アニュイティの使用上の注意(抜粋)
2.重要な基本的注意
(7)全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤の投与により全身性の作用(クッシング症候群、クッシング様症状、副腎皮質機能抑制、小児の成長遅延、骨密度の低下、白内障、緑内障を含む)が発現する可能性があるので、吸入ステロイド剤の投与量は患者毎に喘息をコントロールできる最少用量に調節すること。特に長期間、大量投与の場合には定期的に検査を行い、全身性の作用が認められた場合には患者の喘息状態を観察しながら適切な処置を行うこと
4.副作用
(1)重大な副作用
アナフィラキシー反応:アナフィラキシー反応(咽頭浮腫、気管支痙攣等)があらわれることがある(頻度不明注))ので、観察を十分に行い、異常が認められた場合には本剤の投与を中止し、適切な処置を行うこと。
注)本剤の有効成分を含む配合剤で認められている副作用であるため頻度不明とした。
9. その他の注意
本剤による喘息患者を対象とした臨床試験において、FF 100μg投与群とプラセボ投与群の肺炎の発現率に差はみられなかったが、FF 200μgを投与した喘息患者において肺炎の発現頻度が増加する傾向が認められている。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。