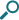製品特性
アニュイティの効果

1日1回1吸入による呼吸機能改善効果
アニュイティ100μg 1日1回と、フルチカゾンプロピオン酸エステル(FP)250μg 1日2回は、プラセボに対し有意な呼吸機能改善効果を示しました(p=0.009、p=0.011:ANCOVA)。
夜のFEV1トラフ値のベースラインからの変化量(投与24週目)(ITT、LOCF)[第III相試験:海外データ(主要評価項目、検証的結果)]
ベースライン値、地域、性別、年齢および投与群を共変量とするANCOVA
承認時評価資料:海外第III相試験(FFA112059試験)より作図
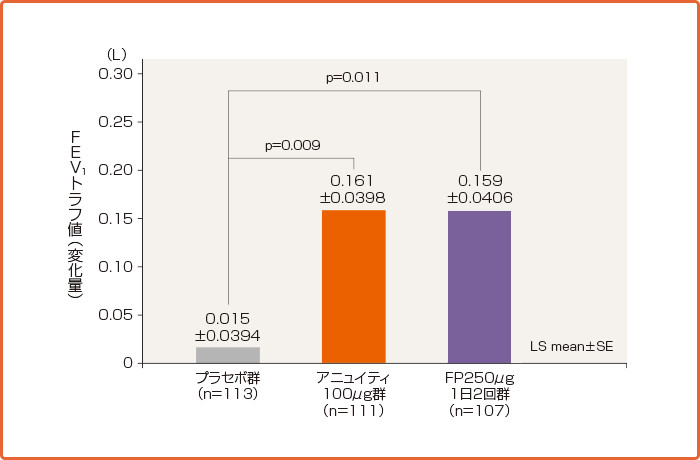
夜のFEV1トラフ値のベースラインからの推移(ITT)[第III相試験:海外データ(24週目:主要評価項目、検証的結果)]
ベースライン値、地域、性別、年齢および投与群を共変量とするANCOVA
承認時評価資料:海外第III相試験(FFA112059試験)
Lötvall J et al:Respir Med 2014;108(1), 41-49
FFA112059試験
目的
持続型気管支喘息患者を対象に、アニュイティ100μgを1日1回夜に24週間吸入投与したときの有効性および安全性を検討する。
対象
低〜中用量のICS[フルチカゾンプロピオン酸エステル(FP)100~500μg/日相当]で喘息コントロール不良※の12歳以上の持続型気管支喘息患者343例
方法
多施設共同・無作為化・二重盲検・プラセボ対照・ダブルダミー・並行群間比較試験。アニュイティ100μgを1日1回夜にエリプタを用いて、フルチカゾンプロピオン酸エステル(FP)250μgを1日2回朝・夜にディスカスを用いて、あるいはプラセボをエリプタまたはディスカスを用いて、いずれも24週間吸入投与した。
評価項目
[ 有効性評価項目 ]
主要評価項目:
投与24週目の夜のFEV1トラフ値のベースラインからの平均変化量
副次評価項目:
治療期間中の24時間発作治療薬未使用日数の割合のベースラインからの平均変化量、治療期間中の毎朝および毎夜のピークフロートラフ値のベースラインからの平均変化量、24時間無症状日数の割合のベースラインからの平均変化量など
その他の評価項目:
24週間の治療期間中に効果不十分により治療を中止した被験者数など
[ 安全性評価項目 ]
有害事象、重度喘息増悪、口腔咽頭検査、臨床検査、24時間尿中コルチゾール排泄量
解析計画
投与24週目の夜のFEV1トラフ値のベースラインからの平均変化量は、Last Observation Carried Forward(LOCF)法により欠測値を補完した投与24週目のデータについて、ITT集団を対象にANCOVAを用いて解析した。
※喘息コントロール不良
投与1日目の試験薬剤投与前のFEV1が予測値の40~90%、前観察期間の最後の7日間のうち4日間以上で日中または夜間の喘息症状スコアが1以上および/またはサルブタモール吸入剤の使用を記録した患者を喘息コントロール不良とした。
承認時評価資料:海外第III相試験(FFA112059試験)
Lötvall J et al:Respir Med 2014;108(1), 41-49
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者にはグラクソ・スミスクライン(株)の社員が含まれた。
本邦において、アニュイティの小児に対する適応はない。FPの小児における最大承認用量は200μg/日である。また、本邦において、FP250μg製剤は販売されていない。
FFA112059試験における安全性[安全性評価項目]
治療期間および後観察期間で、副作用は、アニュイティ100μg群10%(11/114例)、FP250μg 1日2回群6%(7/114例)、プラセボ群6%(7/115例)に発現した。いずれかの群で3%以上に認められた副作用は、口腔カンジダ症および中咽頭カンジダ症[いずれもアニュイティ100μg群3%(3例)]であった。試験薬剤の投与中止または試験中止に至った有害事象は、アニュイティ100μg群3%(3例:咽喉刺激感、クローン病、気管支炎各1例)、FP250μg 1日2回群3%(3例:呼吸困難/動悸/筋肉痛/激越/そう痒症、歯痛、頭痛各1例)、プラセボ群2%(2例:咳嗽、神経皮膚炎各1例)に計13件発現し、そのうち7件が副作用と判定された。本試験において、重篤な副作用および死亡に至った有害事象の報告はなかった。
承認時評価資料:海外第III相試験(FFA112059試験)
Lötvall J et al:Respir Med 2014;108(1), 41-49

レルベアからのステップダウン時の喘息コントロール
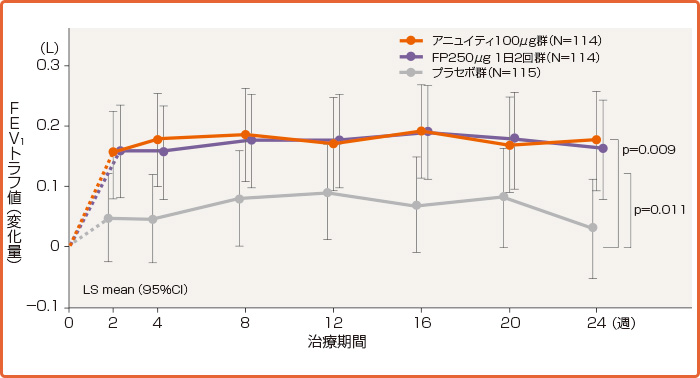
アニュイティへの切り替え後、喘息コントロール良好であった患者の割合は89.5%でした。
喘息コントロール良好の条件を満たす患者の割合(治療期間終了時)(ITT、OC※)[国内第III相試験(複合主要評価項目)]
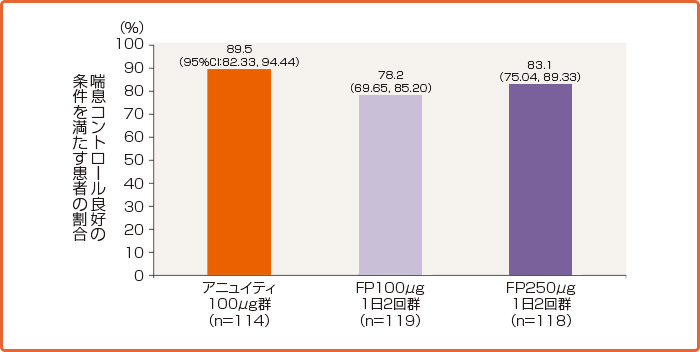
承認時評価資料:国内第Ⅲ相試験(201135試験)
Adachi M et al:Respir Med 2016; 120, 78-86より作図
※喘息症状の悪化・増悪以外の理由で治療期間終了前に試験を中止した患者は除外した。
201135試験
目的
レルベア100により喘息コントロールが良好※1に維持されている気管支喘息患者を対象に、アニュイティ100μg 1日1回、フルチカゾンプロピオン酸エステル(FP)100μg 1日2回またはFP250μg 1日2回吸入投与にステップダウンし、12週間吸入投与したときの有効性および安全性を比較検討する。
対象
レルベア100により喘息コントロールが良好※1に維持されている18歳以上の気管支喘息患者371例
方法
多施設共同・無作為化・二重盲検・ダブルダミー・実薬対照・並行群間試験。中用量ICS/LABA(FP/サルメテロール500/100μg/日またはそれらと同等量)で安定している患者にレルベア100を1日1回夜にエリプタを用いて8週間吸入投与した後、喘息コントロールが良好※1に維持されている患者を無作為に割り付け、アニュイティ100μgを1日1回夜にエリプタを用いて、あるいはFP100μgまたはFP250μgを1日2回朝・夜にディスカスを用いて、12週間吸入投与した。
評価項目
[ 有効性評価項目 ]
複合主要評価項目:
治療期間中に喘息コントロール不良※1(ステップアップが必要)による中止に至るまでの時間、治療期間終了時に喘息コントロール良好※1の条件を満たす患者の割合
副次評価項目:
治療期間終了時のFEV1トラフ値のベースラインからの平均変化量、治療期間における毎朝および毎夜のピークフロー値のベースラインからの平均変化量、24時間無症状日数の割合のベースラインからの平均変化量、24時間発作治療薬未使用日数の割合のベースラインからの平均変化量など
[ 安全性評価項目 ]
有害事象、重篤な有害事象、臨床検査、口腔咽頭検査、重度喘息増悪
解析計画
ITT集団を対象に、治療期間中に喘息コントロール不良※1により中止した患者の割合を投与群別に算出し、その95%CIを正確な二項分布に基づき推定した。また、投与群ごとに、喘息コントロール不良※1による中止に至るまでの時間について、Cox比例ハザード回帰モデルに基づいた累積発生率曲線を表示した。治療期間終了時に喘息コントロール良好※1の条件を満たす患者の割合を投与群別に算出し、その95%CIを正確な二項分布に基づき推定した。
※1 喘息コントロール良好および喘息コントロール不良の定義
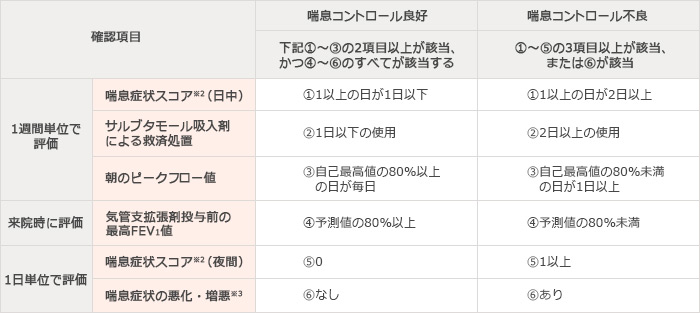
※2 喘息症状スコア
患者は、下記の喘息症状スコアを毎晩(午後)、発作治療薬の使用前、試験薬剤の投与前およびピークフロー値の測定前に電子日記に記録する。
<日中の喘息症状スコア>
0:日中に症状はなかった
1:短時間の症状が、日中に一度だけあった
2:短時間の症状が、日中に二度以上あった
3:日中ほとんどずっと症状があったが、日常生活には支障なかった
4:日中ほとんどずっと症状があり、日常生活に支障があった
5:症状がひどく、仕事や学校に行けなかった、もしくはふつうに日常生活を送れなかった
患者は、下記の喘息症状スコアを毎朝(午前)、発作治療薬の使用前、試験薬剤の投与前およびピークフロー値の測定前に電子日記に記録する。
<夜間の喘息症状スコア>
0:夜間に症状はなかった
1:症状のせいで、夜間に一度目が覚めた(または早く目が覚めた)
2:症状のせいで、夜間に二度以上目が覚めた(早く目が覚めたのも含めて)
3:症状のせいで、ほとんど一晩中眠れなかった
4:症状がひどく、まったく眠れなかった
※3 喘息症状の悪化・増悪
本試験の目的に従って、患者に重度の喘息増悪が発現した場合、喘息症状の悪化が認められた場合、あるいは治験責任医師等により喘息の増悪と判断された場合、「喘息コントロール不良(ステップアップが必要)」として当該患者の試験を中止した。重度の喘息増悪は、経口の全身性ステロイド薬(錠剤、懸濁剤は3日間以上)もしくは注射剤の使用を必要とする喘息症状の悪化、または全身性ステロイド薬の投与を必要とする入院あるいは救急診療部の受診を伴う喘息症状の悪化と定義した。喘息症状の悪化は、治験責任医師等の判断により、試験薬剤または発作治療薬以外の治療を必要とする状態と定義した。
承認時評価資料:国内第III相試験(201135試験)
Adachi M et al:Respir Med 2016; 120, 78-86
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者にはグラクソ・スミスクライン(株)の社員が含まれた。
本邦において、FP250μg製剤は販売されていない。
アニュイティ100μgを中止/中断する場合には、患者の喘息症状を長期に観察し、慎重に行うこと。
201135試験における安全性[安全性評価項目]
治療期間および後観察期間で副作用は、アニュイティ100μg群4%(5/123例)、FP100μg 1日2回群4%(5/124例)、FP250μg 1日2回群2%(3/124例)に発現した。副作用の内訳は、アニュイティ100μg群で口腔カンジダ症4例(3%)、口唇上皮剥脱1例(<1%)、FP100μg 1日2回群で口腔カンジダ症、カンジダ感染、喘息、口腔内潰瘍形成、味覚異常各1例(<1%)、FP250μg 1日2回群で口腔カンジダ症2例(2%)、喘息1例(<1%)であった。試験薬剤の投与中止に至った有害事象は、アニュイティ100μg群2%(鼻咽頭炎、完全流産各1例)、FP100μg 1日2回群3%(鼻咽頭炎3例、喘息1例)、FP250μg 1日2回群1%未満(喘息1例)に発現した。本試験において、いずれの群においても、重篤な副作用および死亡に至った有害事象の報告はなかった。
承認時評価資料:国内第III相試験(201135試験)
Adachi M et al:Respir Med 2016; 120, 78-86
アニュイティの用法・用量
通常、成人にはアニュイティ100μgエリプタ1吸入(フルチカゾンフランカルボン酸エステルとして100μg)を1日1回吸入投与する。
なお、症状に応じてアニュイティ200μgエリプタ1吸入(フルチカゾンフランカルボン酸エステルとして200μg)を1日1回吸入投与する。
アニュイティの使用上の注意(抜粋)
2.重要な基本的注意
(4)本剤の投与期間中に発現する急性の発作に対しては、短時間作動型吸入β2刺激剤等の他の適切な薬剤を使用するよう患者に注意を与えること。
また、その薬剤の使用量が増加したり、あるいは効果が十分でなくなってきた場合には、喘息の管理が十分でないことが考えられるので、可及的速やかに医療機関を受診し医師の治療を求めるよう患者に注意を与えること。
(6)本剤の投与を突然中止すると喘息の急激な悪化を起こすことがあるので、投与を中止する場合には患者の喘息症状を観察しながら徐々に減量していくこと。
4.副作用
(1)重大な副作用
アナフィラキシー反応:アナフィラキシー反応(咽頭浮腫、気管支痙攣等)があらわれることがある(頻度不明注))ので、観察を十分に行い、異常が認められた場合には本剤の投与を中止し、適切な処置を行うこと。
注)本剤の有効成分を含む配合剤で認められている副作用であるため頻度不明とした。
6. 小児等への投与
小児等に対する安全性は確立していない(国内での使用経験がない)。
フルチカゾンプロピオン酸エステルの用法・用量
成人には、フルチカゾンプロピオン酸エステルとして通常1回100μgを1日2回吸入投与する。
なお、症状により適宜増減するが、1日の最大投与量は800μgを限度とする。
小児には、フルチカゾンプロピオン酸エステルとして通常1回50μgを1日2回吸入投与する。
なお、症状により適宜増減するが、1日の最大投与量は200μgを限度とする。
フルチカゾンプロピオン酸エステルの使用上の注意(抜粋)
7. 小児等への投与
(1)全身性ステロイド剤と比較し可能性は低いが、吸入ステロイド剤を特に長期間、大量に投与する場合に成長遅延をきたすおそれがある。長期間投与する場合には投与量は患者毎に喘息をコントロールできる最少用量に調節することとし、身長等の経過の観察を十分行うこと。また使用にあたっては、使用法を正しく指導すること。
■ 本剤の「禁忌を含む使用上の注意」等については添付文書をご参照ください。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。